Wodór (H, łac. hydrogenium) – pierwiastek chemiczny, niemetal z bloku s układu okresowego. Jest to najprostszy możliwy pierwiastek o liczbie atomowej 1, składający się z jednego protonu i jednego elektronu.
Rozpoczyna układ okresowy. Jest wyznacznikiem w szeregu aktywności metali, który oddziela metale wypierające wodór i na niewypierające go.
Istnieje w postaci dwóch stabilnych izotopów 1H (prot) i 2H (deuter, D) oraz niestabilnego – 3H (tryt, T).
Mimo iż wodór jest niemetalem, w warunkach wysokiego ciśnienia przechodzi do stanu metalicznego.
Występowanie
Wodór jest najpowszechniej występującym pierwiastkiem we Wszechświecie. Występuje w gwiazdach i obłokach międzygwiazdowych.
W stanie wolnym występuje w postaci gazowych cząsteczek dwuatomowych H2 tworząc wodór cząsteczkowy, na Ziemi w tej postaci występuje w górnej warstwie atmosfery (0,9%).
W postaci związanej wchodzi w skład wielu związków nieorganicznych (np.: wody, kwasów, zasad, wodorotlenków) oraz związków organicznych (węglowodory i ich pochodne).
Kation wodorowy [edytuj]
Kation wodorowy H+ jest w istocie równoważny protonowi. W stanie wolnym występuje on w próżni, plazmie i górnych warstwach atmosfery ziemskiej (promienie UV jonizują atomy wodoru). W roztworach wodnych kation ten jest natychmiast solwatowany do jonu hydroniowego H3O+:
- H+ + H2O → H3O+
Czasami, w równaniach dysocjacji elektrolitycznej podaje się uproszczenie H3O+ i pisze się po prostu H+, co zupełnie mija się z prawdą. Z tego względu należy pamiętać, że skala pH jest miarą stężenia jonów hydroniowych, a nie wodorowych.
Serie widmowe
Wodór ma charakterystyczne serie widmowe:
- seria Lymana
- seria Balmera
- seria Paschena
- seria Bracketta
- seria Pfunda
- seria Humpreysa
Prawdopodobnie pierwszą osobą, która opisała otrzymywanie wodoru w stanie czystym był alchemik Paracelsus żyjący w latach 1493–1541. Paracelsus wykonywał eksperymenty polegające na wrzucaniu metali do kwasów i zbieraniu do naczyń gazowych produktów tych reakcji, co do dzisiaj stanowi najprostszy sposób otrzymywania tego pierwiastka w warunkach laboratoryjnych. Przypuszcza się jednak, że podobne eksperymenty wykonywano już wcześniej.
Eksperymenty te powtórzył w 1661 r. Robert Boyle, który opisał też wybuchową naturę mieszanki wodoru z powietrzem, zwanej dziś mieszaniną piorunującą, a wówczas aria tonante - z włoskiego - "powietrze grzmiące". Pierwszą osobą, która uznała wodór za pierwiastek, a właściwie flogiston, czyli "pierwiastek palności", będący przedmiotem błędnej teorii flogistonowej i reliktem wielowiekowej tradycji alchemii, był Henry Cavendish. W 1766 r. zamieścił w swoich notatkach taką tezę. Jak wszystkie inne badania angielskiego arystokraty nie zostało to jednak opublikowane za jego życia. Substancja ta została uznana za pierwiastek dzięki badaniom Antoine Lavoisiera nad otrzymywaniem wody z wodoru i tlenu w 1783 r. Pierwotnie polska nazwa, przetłumaczona z łaciny przez Jędrzeja Śniadeckiego brzmiała "wodoród". Nazwę tą przyjęli także Chodkiewicz, Fonberg, Krzyżanowski i Radwański, który używał także nazwy "lżeń". W projekcie warszawskim określano nowy pierwiastek mianem "wodor", Matecki pisał "wód", a Czyrniański "wod", następnie także "wód". Z biegiem czasu została skrócona do powszechnie dziś znanej którą Jako pierwszy nazwę "wodór" zaproponował Filip Walter, co zatwierdziła krakowska Akademia Umiejętności w roku 1900.
Otrzymywanie
Na skalę przemysłową wodór otrzymuje się następującymi metodami:
- Poprzez konwersję realizowaną podczas przepuszczania alkanu nad parą wodną:
- CxH2y + 2xH2O → (2x+y)H2 + xCO2
- CH4 + 2H2O → 4H2 + CO2
- C + H2O → CO + H2
- 2CH4 –T=2000 °C→ C2H2 + 3H2
2CH4 + O2 → 2CO + 4 H2
W laboratorium można go otrzymać na kilka sposobów:
- 2H2O → 2H2 +O2
- np. Zn + 2HCl → ZnCl2 + H2↑
- Spalanie magnezu w parze wodnej:
- Mg + H2O → MgO + H2↑
- np. 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
Powyższe reakcje roztwarzania metali wykonywać można dogodnie w aparacie Kippa.
Izotopy wodoru
Wodór występuje w 3 różnych izotopach: prot, deuter i tryt.
W skład jądra wchodzi jeden proton. Nie posiada neutronów. Jest izotopem stabilnym
W skład jądra wchodzi 1 proton i jeden neutron. Jest izotopem stabilnym. Ze względu na to, że deuter ma dwukrotnie większą masę od protu, różnią się one znacząco właściwościami fizycznymi, a także chemicznymi (silny efekt izotopowy).
W skład jądra wchodzi jeden proton i 2 neutrony. Jest izotopem niestabilnym. Ulega rozpadowi β- z powstaniem helu-3.
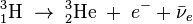
Zastosowanie
Dawniej wodór był stosowany do napełniania balonów sterowców, lecz z powodu jego łatwości wybuchu zrezygnowano z dalszego napełniania wodorem. Skroplony wodór znalazł zastosowanie jako paliwo w silnikach rakietowych. Jest tak lekki, że nie potrzeba pomp, aby napełniać nim zbiorniki promu kosmicznego. Naukowcy pracują nad możliwością stworzenia ogniw paliwowych napędzanych wodorem, które mogłyby służyć jako źródło napędu dla wielu pojazdów i urządzeń. Izotop wodoru – tryt – wykorzystywany jest w reakcjach termojądrowych, które mogą potencjalnie stanowić źródło taniej i czystej energii. Inny jego izotop – deuter – wykorzystywany jest jako spowalniacz (moderator) w reaktorach atomowych. Związki zawierające deuter są wykorzystywane do przygotowanie próbek NMR ze względu na właściwości fizykochemiczne tego atomu.
Wodór używany jest także w elektrowniach do chłodzenia generatorów dużej mocy (powyżej 500 MW).
W chemii organicznej wodór może być użyty do:
- C2H4 + H2 → C2H6
- redukcji związków tlenowych
Związki wodoru

